
Innehållsförteckning:
- Tillbehör
- Steg 1: Välja en 3D -skrivare
- Steg 2: 3D -utskrift
- Steg 3: Förbered skrivaren för ändring
- Steg 4: Utbytbart fäste
- Steg 5: Z -axelbrytare
- Steg 6: Kabeldragning
- Steg 7: Epoxiextruder
- Steg 8: Vanlig Paste Extruder
- Steg 9: Steg 9: Arduino -firmware
- Steg 10: Cura -profil
- Steg 11: Ändra Start G-kod
- Steg 12: Gör Bioink
- Steg 13: Skriv ut
- Författare John Day day@howwhatproduce.com.
- Public 2024-01-30 12:43.
- Senast ändrad 2025-01-23 15:11.



Vi är ett forskargrupp under UC Davis. Vi är en del av BioInnovation Group, som verkar i TEAM Molecular Prototyping and BioInnovation Lab (rådgivare Dr. Marc Facciotti och Andrew Yao, MS). Labbet sammanför studenter med olika bakgrund för att arbeta med detta projekt (mek/kemisk/biomed teknik).
En liten bakgrund till detta projekt är att vi började skriva ut transgena risceller i samarbete med Dr. Karen McDonald på ChemE-avdelningen med målet att utveckla en billig bioprinter för att göra biotryck mer tillgängligt för forskningsinstitutioner. För närvarande kostar low-end bioprinters cirka $ 10 000 medan high-end bioprinters kostar cirka $ 170 000. Däremot kan vår skrivare byggas för cirka $ 375.
Tillbehör
Delar:
- Ramper 1.4:
- Arduino mega 2560:
- Stegmotordrivrutiner:
- Ytterligare stegmotor (tillval)
- Makerbalk 2 i X 1 in
- Maskinvara för fästbalk
- M3 -skruvar i olika storlekar
- M3 muttrar x2
- 8 mm gängad stång
- 8 mm mutter
- 608 lager
- Pappersklämma
- Tråd
- Monoprice V2
- Buntband
- M3 värmeställningsmuttrar 2 mm bredd
Verktyg:
- Borrbitar i olika storlekar
- Handborr
- Borrpress
- Bågfil
- Lödkolv + löd
- Wire stripper
- Nåltång
- Hexnycklar i olika storlekar
Labtillbehör:
- Petriskålar ~ 70 mm diameter
- 60 ml spruta med Luer-lock spets
- 10 ml spruta med Luer-lock spets
- Luer-låsbeslag
- Slangar för beslag
- T Anslutning för slangar
- Centrifug
- Centrifugrör 60 ml
- Skala
- Väg båtar
- Autoklav
- Bäcker
- Graderad cylinder
- 0,1 M CaCl2 -lösning
- Agarose
- Alginat
- Metylcellulosa
- Sackaros
Programvara:
- Fusion 360 eller Solidworks
- Arduino IDE
- Repetier -värd
- Ultimaker Cura 4
Steg 1: Välja en 3D -skrivare

Vi valde Monoprice MP Select Mini 3D Printer V2 som startande 3D -skrivare. Denna skrivare valdes på grund av dess låga kostnad och höga tillgänglighet. Dessutom fanns redan en mycket exakt 3D -modell av skrivaren som gjorde designen enklare. Denna instruktion kommer att skräddarsys för denna specifika skrivare men en liknande process kan användas för att konvertera andra vanliga FDM -skrivare och CNC -maskiner.
Modell med hög noggrannhet:
Steg 2: 3D -utskrift

Innan monoprisen av Monoprice -skrivaren demonteras måste flera delar 3D -skrivas ut för att modifiera 3D -skrivaren. Det finns versioner av pastaxtruderarna, en som kräver epoxi och en som inte gör det. Den som kräver epoxi är mer kompakt men svårare att montera.
Steg 3: Förbered skrivaren för ändring

Den främre tornpanelen, bottenluckan och kontrollpanelen ska tas bort. När botten har tagits bort, koppla bort all elektronik från styrkortet och ta bort styrkortet.
Steg 4: Utbytbart fäste



Kropp 1 och stomme 14 kräver två värmemuttrar. Kropp 1 monteras på skrivarramen av de två M3 -bultarna som är gömda under bältet. Bultarna kan avslöjas genom att ta bort remspännaren och dra remmen åt sidan.
Steg 5: Z -axelbrytare


Z-axelomkopplaren är omplacerad så att vilken nål som helst kan användas under homing-sekvensen utan att kompensera i programvaran. Omkopplaren ska monteras med 2 M3 -skruvar på skrivarchassit direkt under skrivhuvudet så nära skrivbädden som möjligt.
Steg 6: Kabeldragning
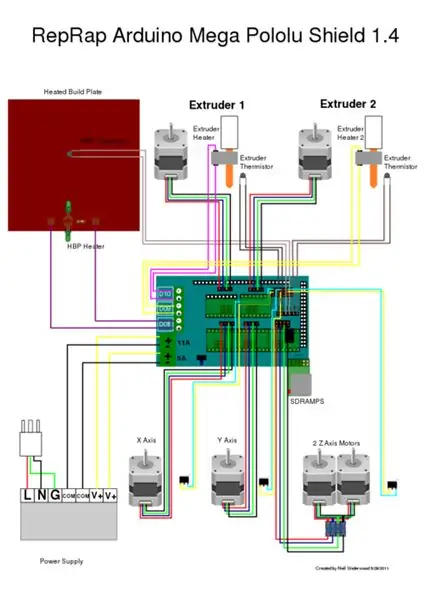


Kabeldragningen görs i enlighet med Ramps 1.4 -standarderna. Följ bara kopplingsschemat. Klipp av och tenntrådar efter behov för kopplingsplintarna. Vissa ledningar kan behöva förlängas.
Steg 7: Epoxiextruder



Även om denna extruder tar mindre tid att skriva ut, använder den dock epoxi som ökar den totala byggtiden till över 24 timmar. Den 8 mm gängade stången ska vara epoxad till 608 -lagret och lagret ska vara epoxat till det 3D -tryckta stycket Body 21. Dessutom ska muttern för den gängade stången vara epoxad till Body 40. När epoxyn har härdats helt ska gummit spetsar från sprutkolvarna på 60 ml och 10 ml kan monteras över kropp 9 respektive kropp 21. En lämplig T -passning kunde inte hittas så en rå var gjord av 6 mm mässingsrör och löd. Extrudern fungerar som ett hydrauliskt system som skjuter ut Bioink ur den nedre kammaren på 10 ml sprutan. Luft kan evakueras ur systemet genom att skaka rören kraftigt medan T -kopplingen hålls på den högsta punkten.
Steg 8: Vanlig Paste Extruder

Denna extruder kan helt enkelt skruvas ihop. Nackdelen med denna extruder är att den är skrymmande och har hög motreaktion.
Steg 9: Steg 9: Arduino -firmware

Arduino behöver firmware för att köra stegdrivrutinerna och annan elektronik. Vi valde Marlin eftersom det är gratis, enkelt modifierat med Arduino IDE och väl stödt. Vi har modifierat firmware för vår specifika hårdvara men det är ganska enkelt att modifiera för andra skrivare eftersom all kod är kommenterad och tydligt förklarad. Dubbelklicka på filen MonopriceV2BioprinterFirmware.ino för att öppna konfigurationsfilerna för marlin.
Steg 10: Cura -profil
Cura -profilen kan importeras till Ultimaker Cura 4.0.0 och användas för att göra maskor med hög yta för användning i en överflödesreaktor. Generationen av Gcode för skrivaren är fortfarande mycket experimentell och kräver mycket tålamod. En testg -kod för en cirkulär profusionreaktor bifogas också.
Steg 11: Ändra Start G-kod

Klistra in den här koden i start-G-kodinställningen:
G1 Z15
G28
G1 Z20 F3000
G92 Z33.7
G90
M82
G92 E0
I Repetier, för att ändra start Gcode, gå till slicer-> Configuration-> G-codes-> start G-codes. Det är nödvändigt att ändra G92 Z-värdet för varje enskilt fall. Öka långsamt värdet tills nålen är önskat avstånd från petriskålens yta i början av utskriften.
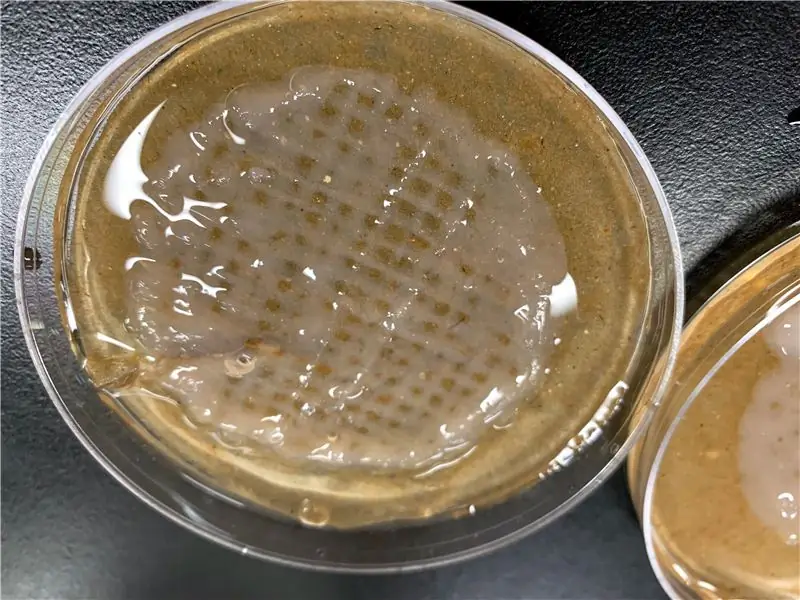
Steg 12: Gör Bioink

Processen för att utveckla en Bioink lämplig för en applikation är komplex. Detta är processen som vi följde:
Sammanfattning
Hydrogeln är lämplig för skjuvkänsliga växtceller och har öppna makroporer för att möjliggöra diffusion. Hydrogeln framställs genom att lösa agaros, alginat, metylcellulosa och sackaros i avjoniserat vatten och tillsätta celler. Gelén är trögflytande tills den härdas med 0,1 M kalciumklorid, vilket gör den robust. Kalciumkloridhärdningslösningen tvärbinder med alginatet för att göra det robust. Alginatet är basen för gelén, metylcellulosen homogeniserar gelén och agarosen ger mer struktur eftersom den gelerar vid rumstemperatur. Sackarosen ger mat för cellerna att fortsätta växa i hydrogel.
En kort översikt över några av experimenten för att verifiera gelen
Vi testade olika hydrogeler med varierande mängder agaros och registrerade dess konsistens, hur lätt den skrevs ut och om den sjönk eller flöt i härdningslösningen. Minskning av alginatprocenten gjorde gelén för flytande och den kunde inte behålla sin form efter utskrift. Ökning av alginatprocenten fick härdningslösningen att fungera så snabbt att gelén skulle härda innan den fastnade vid det översta lagret. En hydrogel som håller sin form och inte härdar för snabbt utvecklades med 2,8 viktprocent alginat.
Hur man utvecklar en hydrogel
Material
Agaros (0,9 viktprocent)
Alginat (2,8 viktprocent)
Metylcellulosa (3,0 viktprocent)
Sackaros (3,0 viktprocent)
Kalciumklorid. 1M (147,001 g/mol)
ddH20
cellaggregat
2 tvättade och torkade bägare
1 Blandande spatel
Aluminiumfolie
Plastpapper
Graderad cylinder
Procedur
Gör Hydrogel:
- Mät upp en specifik mängd ddH20 baserat på hur mycket gellösning du vill förbereda. Använd graderad cylinder för att få en specifik volym ddH20.
- Hydrogellösningen innehåller Alginat (2,8 viktprocent)), Agaros (0,9 viktprocent), sackaros (3 viktprocent) och metylcellulosa (3 viktprocent). Korrekta delar av komponenterna i hydrogellösningen kommer att mätas med plastpapper.
- När du har vägt alla komponenter tillsätt ddh20, sackaros, agaros och slutligen natriumalginat till en av de torra bägarna. Snurra för att blanda men använd inte en spatel för att blanda eftersom pulvret fastnar på spateln.
- När den är blandad, linda toppen av bägaren med aluminiumfolie ordentligt och märk bägaren. Lägg en bit autoklavtejp på toppen av folien.
- Lägg den återstående metylcellulosen i den andra torra bägaren och linda den i aluminiumfolie som den föregående bägaren. Märk denna bägare och lägg till en bit autoklavtejp på foliens ovansida.
- Slå in en spatel i aluminiumfolie och se till att inget av den utsätts. Lägg till autoklavtejp till den inslagna spateln.
- Autoklav de två bägare och 1 spatel vid 121 C i 20 minuter under steriliseringscykeln. ANVÄND INTE AUTOKLAVEN I EN STERIL & TORR CYKLUS.
- När autoklavcykeln är klar, låt gelén svalna till rumstemperatur och när den har nått den, börja arbeta i det biologiska säkerhetsskåpet.
- Var noga med att tvätta händer och armar och använd korrekt aseptisk teknik när du har använt den i biosäkerhetsskåpet. Se också till att inte komma i direkt kontakt med föremål som kommer att vidröra gelén eller vara nära gelén (t.ex.: spatelens blandningsände eller området för aluminiumfolierna som sitter över gelén)
- Blanda metylcellulosan i gelén i biosäkerhetsskåpet för att få en homogen spridning. När blandningen är klar, packar du upp den blandade gellösningen på toppen och ställer i kylen över natten.
- Härifrån kan gelén användas för introduktion av cellerna eller för andra användningsområden som utskrift.
Lägga till cellerna:
-
Filtrera cellerna så att de har samma storlek. Vår procedur för filtrering är
Skrapa lätt cellerna från petriskålen och använd en 380 mikrometer sil för att filtrera cellerna.
- Blanda försiktigt de filtrerade cellerna i hydrogellösningen med en platt huvudspatel för att undvika förlust av blandningen (som har autoklaverats).
- Efter blandning centrifugeras cellerna ut bubblor
- Härifrån är hydrogel komplett och kan användas för utskrift, härdning och framtida experiment.
Hur man utvecklar härdningslösningen (0,1 M kalciumklorid, CaCl2)
Material
Kalciumklorid
ddH20
Sackaros (3 viktprocent)
Förfarande (för att göra 1L härdningslösning)
- Mät 147,01 g kalciumklorid, 30 ml sackaros och 1 L ddH20.
- Blanda kalciumklorid, sackaros och ddH20 i en stor bägare eller behållare.
- Sänk ner gelen i härdningslösningen i minst 10 minuter för att härda.
Steg 13: Skriv ut
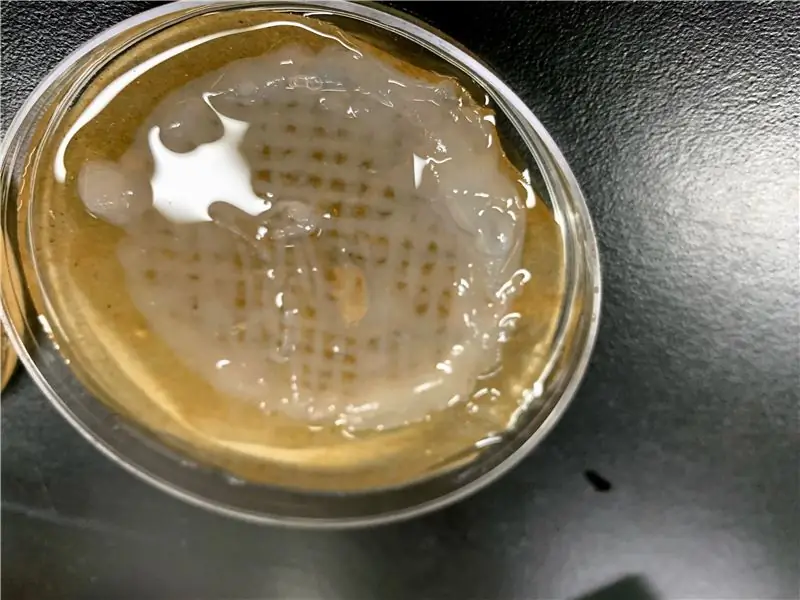
I teorin är Bioprinting extremt enkelt; men i praktiken finns det många faktorer som kan orsaka fel. Med denna gel har vi funnit att flera saker kan göras för att maximera framgång för vår applikation:
- Använd små mängder CaCl2 -lösning för att delvis härda gelen under utskrift,
- Använd en pappershandduk i botten av petriskålen för att öka vidhäftningen
- Använd en pappershandduk för att jämnt fördela små mängder CaCl2 över hela utskriften
- Använd reglaget för flödeshastighet i Repetier för att hitta rätt flödeshastighet
För olika applikationer och olika geler kan olika tekniker behöva användas. Vår procedur genererades under flera månader. Tålamod är nyckeln.
Lycka till om du försöker detta projekt och ställ gärna frågor.


Första priset i Arduino -tävlingen 2019
Rekommenderad:
Ta fantastiska bilder med en iPhone: 9 steg (med bilder)

Ta fantastiska bilder med en iPhone: De flesta av oss har en smartphone med oss överallt nuförtiden, så det är viktigt att veta hur du använder din smartphone -kamera för att ta fantastiska bilder! Jag har bara haft en smartphone i ett par år, och jag har älskat att ha en bra kamera för att dokumentera saker jag
Hur: Installera Raspberry PI 4 Headless (VNC) med Rpi-imager och bilder: 7 steg (med bilder)

Hur: Installera Raspberry PI 4 Headless (VNC) med Rpi-imager och bilder: Jag planerar att använda denna Rapsberry PI i ett gäng roliga projekt tillbaka i min blogg. Kolla gärna in det. Jag ville börja använda mitt Raspberry PI men jag hade inte ett tangentbord eller en mus på min nya plats. Det var ett tag sedan jag installerade en hallon
Hur man digitaliserar bilder och filmnegativ med en DSLR: 12 steg (med bilder)

Hur man digitaliserar diabilder och filmnegativ med en DSLR: En mångsidig och stabil inställning för digitalisering av diabilder och negativ med en DSLR eller en kamera med ett makroalternativ. Denna instruerbara är en uppdatering av Hur man digitaliserar 35 mm negativ (uppladdad juli 2011) med flera förbättringar för att utöka dess
Hur man tar isär en dator med enkla steg och bilder: 13 steg (med bilder)

Hur man tar isär en dator med enkla steg och bilder: Detta är en instruktion om hur man demonterar en dator. De flesta av de grundläggande komponenterna är modulära och lätt att ta bort. Det är dock viktigt att du är organiserad kring det. Detta hjälper dig att inte förlora delar, och även för att göra ommonteringen
Gör 3D-bilder av dina kretskort med Eagle3D och POV-Ray: 5 steg (med bilder)

Gör 3D-bilder av dina PCB med Eagle3D och POV-Ray: Med Eagle3D och POV-Ray kan du göra realistiska 3D-renderingar av dina PCB. Eagle3D är ett manus för EAGLE Layout Editor. Detta kommer att generera en strålspårningsfil som kommer att skickas till POV-Ray, som i sin tur kommer att dyka upp den färdiga bilden
